오늘은 제약회사 용어를 알아보는 3번째 시간.
1, 2편은 너무 쉬웠는지 다들 술술 읽혔겠지만
내가 설명을 잘함
오늘은 좀 어려운 내용을 가져왔다.
그래도 믿고 가보자
1. 기술이전
제약회사 채용공고를 보다보면 아마 한 두 번씩은
보았을 그 단어
“기술이전”
많은 취업 준비생들이 가고 싶어하는 회사 중 하나인
삼성바이오로직스 회사 채용 공고에서도 여러번 봤지?
다른회사들도 부서 이름은 좀 다르긴해도
이런 업무를 하는 팀이 존재하기도 한다.
근데 취업을 준비하는 입장에서
이 기술이전이라는 단어는
다소 생소할 것이다.
무슨 기술을?
누구한테?
어디다가 이전시키는거야?
누구한테 알려주는건데?
그죠?


ㅋㅋ 이 기술을 알려줄 수 있는데요?
그래 그것도 어려운 기술이긴 한데
오늘은 제약회사의 기술이전을
알아 볼 거다.
ICH Q10 [1] 3.1.2항에서 기술 이전을 다음과 같이 정의된다.
“기술 이전 활동의 목표는 제품과 공정 지식을 개발과 제조 간 또는 제조 사이에서 이전하여 제품 실현을 달성하는 것입니다. 이러한 지식은 공정 제어 전략, 공정 검증 접근, 지속적인 지속적 개선의 기반을 형성합니다.”
ICH 뭐요? 아이씨 난이도가 극상으로 가시네
ICH는
International Council for Harmonization
우리나라 말로는
“국제의약품규제조화위원회” 를 뜻한다.
근데 이게 뭐냐?
내 예전 글을 봤다면 탈리도마이드 사건을 기억하지?
기억이 안난다고? 기억재생술
기억이 돌아오신 분만 계속 읽으시오.
자 이 사건 이후로
킹갓cGMP형님이 짱을 먹고
다른 나라들은 각자마다
KGMP, EUGMP등을 만들었다.
그러면서
“우리나라에다가 약을 팔라면 말이야
제대로 만들어서 가지고오라고오오~”
하는 규정들을 만들어냈지
근데 이게 나라별로 만들다보니
A 국가에서 말하는 고품질하고
B 국가에서 말하는 고품질하고 서로 막 달라

C 국가에서
 “크크 우리 약은 겁나 과학적인 근거 자료를 토대로 만듦”
“크크 우리 약은 겁나 과학적인 근거 자료를 토대로 만듦”
을 시전했는데
미쿡에서
 “what the? 이딴게 Science?, 줘품질 땅땅”
“what the? 이딴게 Science?, 줘품질 땅땅”
이래버리는 거지
이렇게 나라별로 상이한 과학적 근거나
규정 근거를 어느정도 통일화 시킬 필요를 느껴서
미쿡,유럽,닛뽄 형님들이 ICH라는
“국제적으로 좀 통일좀 하자!”
하는 기구를 설립했지
그리고 우리나라도 2016년에 가입국이 되어서
요걸 따르고 있다는 말씀
ICH 가이드에는
Quality(Q), Safety(S), Efficacy(E), 그리고 Multidisciplinary(M)
이렇게 4가지 내용을 다루고 있는데
Q쪽에선
Q1A(R2) – Stability Testing of New Drug Substances and Products
Q1B – Photostability Testing of New Drug Substances and Products
Q1C – Stability Testing for New Dosage Forms
Q1D – Bracketing and Matrixing Designs for Stability Testing of New Drug Substances and Products
Q1E – Evaluation of Stability Data
…
…
쓰다보니 귀찮다
직접 들어가서 보아라
암튼 기술이전에 대한 정의는
ICH에 따르면
“기술 이전 활동의 목표는 제품과 공정 지식을 개발과 제조 간 또는 제조 사이에서 이전하여 제품 실현을 달성하는 것입니다. 이러한 지식은 공정 제어 전략, 공정 검증 접근, 지속적인 지속적 개선의 기반을 형성합니다.”
이라고 되어있다.
쉽게 말하면
약을 개발한 곳 → 약을 생산하는 사이트 or
내꺼 약을 만들어줘! → 예, 만들어드리겠습니다 하는 쪽으로
생산과 품질관리 방법등에 대해 알려주는 작업을
기술이전
이라고 한다.
여기서 기술을 이전해주는 조직을
Sending unit (SU)
받는 조직을
Receiving unit (RU) 이라고 하며
단순히 생산 방법,
실험 방법만 이전하는게 아니고
엄청 다양한 업무들을 한다.
예를 들어주겠다.
SU에서RU로 넘어갈 것들의 예시로는
- 과학적인 제품 운영 정보
- 제품 품질 속성 (예: CQAs 및 재료 속성)
- 프로세스 개요, 단위 작업 포함 (예: 공정 흐름도, CPPs, 재료 속성 등에 대한 참조)
- Control 전략
- 지속적인 개선 아이디어와 계획
- 경험을 통해 알 수 있는 지식 및 지식전수법
- 건강, 안전 및 환경 (HSE) 요구 사항
- 이전 협력 활동에서 얻은 내용
- 프로세스 분석 기술 (PAT), 다변량 데이터 분석, 모델 교정 등과 같은 전문 도구 및 기술 사용에 대한 내용
- 제품 품질에 대한 잠재적 위험 분석 데이터
등이 함께 넘어간다.
단계적으로 보면 기술 이전은
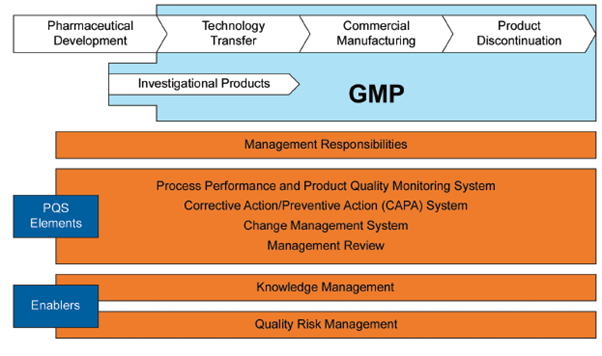
출처 : ISPE Guideline : Technology Transfer
저기 Technology Transfer 보이지? 저기에 해당한다.
근데
이게 다냐구?
아니 이건 기술이전 시
포함되어야 하는 내용의
1/30 도 안되는 내용만 넣었다.
어차피 실무를 해보지 않는 이상
이해할 수 없을테니
굳이 디테일하게 언급은 안하겠다.
그리고 여기까지 읽으면서
무슨 소린지 모르겠다 하는게 정상이니
너무 걱정하지말고
아~ 의약품을 개발해서
생산사이트로 넘길 때
모든 필요한 데이터를 다
넘기는 게 기술이전 이구나
이 정도만 이해하셔도 성공이다.
2. 기술이전의 단계
기술이전 시
사실 이 약을 왜 이렇게 개발했고
왜 이러한 시험법으로 검증하는지 등
뭔가 지식적인 (지식은 Knowledge) 것도
가르쳐줘야 하지 않을까? 그치?
그래서 기술이전을 크게 보면
4~6단계로 보통 구분짓기도 한다.

출처 : PDA TR 65 Technology transfer
여기 3번째 단계에서
앞서 말했던
지식도 넘겨주는 걸 볼 수 있다.
1개의 기술이전 프로젝트를 진행하더라도
정말 많은 부서들이 참여를 하게 되는데
예를 들면
경영, 전략기획, 회계 팀 등에서 비용과 S/F (판매 예상), 시장성 등을 분석하고
연구소, 공무, 공장 내 팀 등에서 RA, 공정설계, 유틸설계, Quality Management 등을 한다.
간략하게 무슨 일들을 하는지는
저 위의 6단계에 맞춰 예시를 들어주겠다.
Initiation 단계에선
- 이거 크게 팔아먹을 수 있는 약임? 돈 됌? 증거보고해봐
- 이 프로젝트 대장 누가할거임? 팀 구성은 어케 할거임?
- 프로젝트 일정 수립해바
- 공정 대충 설계해바
- 시설 비용 얼마 드는지 검토해봐
- 어느 국가에 팔거야? 규제 검토해봐
등의 업무를 하게 된다.
Planning 단계에선
- 돈 (예산) 주세요~
- 사람 뽑아주세여~
- 프로젝트 일정 나옴 ㅋ
- 최종 협의자들은 요 사람들입니다~
- 실험에서 요런 문제들이 있겠네요
- 공정에선 요런 문제들이 있을거같구요
- 그 문제들은 이렇게 예방해야 될거같네요
- 안전 수칙 지켜 이런거 지키면서 해야돼 알았어?
- 품질 수칙 지키세요 수칙은 여깄습니당
등의 업무를 한다.
세 번째,
Knowledge transfer단계에선
- 사람 뽑습니더~ 지원들 하십쇼
- 이 팀 대장은 엄준식님 입니다. 앞으로 매주 보고해주십쇼
- 공정 흐름도는 이렇습니다
- 품질 평가는 이렇게 진행됩니다 아셨습니까? 휴먼?
- 세척은 이렇게 해야되구요
- 공조는 이렇게, 전기는 이렇게
- 인력 운영은 이렇게, 현장에서 사람과 물건은 이렇게
- 이거 원료는 어느 업체꺼 쓸거지? 걔네 평가들어간다
- 교육 받으셨으면 기록 남겨주십쇼~
등의 업무를 한다.
Readiness 단계에선
- 유럽님 저희 약 이렇게 준비중인데 통과좀?
- 미국님도 좀 통과좀?
- 기술이전 계획서 쓰쟈
- 공정 평가 계획서 쓰자~
- 세척 평가 계획도 쓰고~ 환경 평가 계획도 쓰고~
- 샘플링 포인트, 홀드 포인트 평가 계획서도 쓰고~
- 필요한 장비도 사고~ 장비 샀으니 장비 평가도 하고
- SOP도 쓰고
- 안전 평가도 쓰고~
- 배치 출하 절차서도 쓰고
- 공정 담당자 교육도 진행하고
- 원료도 사들이고
등의 업무를 한다.
드디어
Execution 단계
실제 기술이전을 수행하는 단계라 보면 된다.
- 제품 런칭 전략 입니다 회장님 ( 어 그래그래)
- FDA형들 우리 이 약 팔거야 한번만 봐줘
- 원료들 GMP 품질에 적합한지 테스트하자
- 장비 평가중 ㅋ
- 세척 방법도 평가 중 ㅋ
- ??? : 안정성 샘플좀 따간다
- 자 라인 가동 함 해보자 드가자~
- 순도 분석 함 해봐라, 제품 평가 함 해봐라~
- QA : 일탈내셨네 이분들 원인분석하고 해결해라
- 배치 데이터 다 가져오세요 검토해야함 ㅋ
등의 업무를 수행하게 된다.
마지막
Handover 단계
기술을 넘겨주는 팀이 받는 팀한테
“이제 혼자할 수 있겠지? ㅅㄱ”
하는 단계다
하는 업무는
- 이 약은 이렇게 팔겁니다 땅땅
- 지금까지 나온 배치로 분석한 데이터들 입니다. 받으십쇼
- 앞으로 필요한 밸리데이션 평가는 공장에서 알아서 하십쇼
- GMP 적으로 잘 관리하셈 ㅃ2
같은 것들을 하는 단계다.
총 6단계에서
각 단계별로 작성한 업무 예시들은
제약회사의 각 부서별로
하는 일들을 몇가지씩만 나열해 둔 것이다.
실제 기술이전에 참여하는 사람이라면
해당 프로세스를 대충이라도 알아야
각 단계별로 내가 어떤 업무를 해야하는지,
그게 왜 필요한지 정도는 알 수 있을거다.
3. ??? : 더 어지러워졌어.
다시 위에서 봤던 MSAT 채용공고를 보자

배양 공정 기술이전 관련GMP 문서 작성은
Readiness 단계에서 기술이전 계획서,
공정 평가서 등을 비롯하여
기술이전과 GMP 준수를 위한
모든 문서 업무들을 하는 것이라 보면 된다.
이것만 말했다고 이것만 한다는게 아니고
위와 같은 문서들을 비롯하여
관련된 모든 GMP 문서 업무를 다 하게된다.
그리고 그 이후의 실행 단계와 핸드 오버 단계까지의
모든 GMP 문서 업무에 대부분 참여하게 된다.
그리고 공정 RA 업무도 쓰여져있는데
단순히 공정 RA만 하는 건 아니고
공정과 관련된 분석, 유틸, 시설
분석, 시험 등과 관련된 내용도
RA를 진행하면서 자연스럽게 다루게 된다.
고객사 응대는 삼바의 경우
CMO 나 CDO, CDMO 수주를 많이 받기 때문에
고객사의 제품 대신 생산해주기 위한 기술이전 중
고갱님이 원하는 것들을 받아주고
커뮤니케이션하고
응대하는 일이라고 보면된다.
앞 서 설명했던 것처럼
기술이전 업무는 단순히 공정만 하는게 아니고
엄청나게 많은 업무가 깔려있다.
삼성 같은 대기업은 업무를 어느 정도 적정인원에게
할당해주는 편이나
타 회사는 그 딴거 없다.
한 두명이 거의 모든 일을 몰빵해야해서
난이도가 상당히 높은 직무 중 하나다.
작성하다보니 내용이 다소 많이 길어졌는데
기술이전에 대한 추가 질문이 있다면 댓글로 달아주길 바란다.
여러 질문들을 모아
내용을 한 번에 업데이트 해주도록 하겠다.










